- · 《生命科学仪器》编辑部[10/30]
- · 《生命科学仪器》杂志社[10/30]
- · 《生命科学仪器》期刊栏[10/30]
- · 《生命科学仪器》数据库[10/30]
- · 《生命科学仪器》投稿方[10/30]
- · 生命科学仪器版面费是多[10/30]
1天深圳大学/山西大学等单位连发5篇Nature,在生(2)
作者:网站采编关键词:
摘要:Nature? 在线发表题为 “Transition from an atomic to a molecular Bose–Einstein condensate” 的研究论文,该研究报告了通过在g波Feshbach共振附近的原子冷凝物中诱导配对





G蛋白偶联受体(GPCR)是人体内最大的膜受体蛋白家族,其在细胞信号传导中发挥重要功能,同时也与人体疾病密切相关,是40%以上的上市药物的作用靶点1。根据结构和序列的差异性,人体中GPCR可分为A、B、C和F四种类型。近年来的结构功能研究分别揭示了A、B1、B2和F类以单体形式发挥功能的GPCP的激活机制2-5。
研究显示单体GPCR偶联G蛋白采用相似的模式,即受体的激活使跨膜结构域TM6的外移,进而形成较大的口袋用于结合Gα亚基的C末端,从而激活G蛋白下游信号通路。然而长期以来,以二聚化形式发挥功能的C型GPCR偶联G蛋白的分子机制一直未能揭示,严重阻碍了人们对C型受体信号转导机制的理解。
C型GPCR主要包括代谢型γ-氨基丁酸受体(GABAB)、代谢型谷氨酸受体(mGlu)、钙敏感受体(CaSR)和味觉受体1(Taste 1)等6。C型受体与众多神经和精神疾病相关,包括癫痫、疼痛、焦虑、抑郁、精神分裂症、药物成瘾、Rett综合征和癫痫性脑病等。GABAB受体是第一个被发现和证明的GPCR异源二聚体,是C型二聚体GPCR的典型代表7,8。
GABAB受体广泛表达在中枢神经系统中,参与学习、记忆和突触信号传递等重要的生理进程9。GABAB受体由GB1和GB2两个亚基组成,每个亚基分别由胞外结构域(VFT),七次跨膜域(TMD)和胞内域构成10。GABAB受体激活采取典型的非对称性调节机制,即GB1的VFT负责配体识别,而GB2的TM偶联Gi/o蛋白调控下游信号。
刘剑峰/张岩合作团队在2020年国际首次鉴定全长GABAB受体非激活态与激活态的精细三维空间结构,阐明了GABAB受体激活时的构象转变过程,鉴定了正向变构调节剂的结合口袋,极大地促进了GABAB受体的激活机制研究和靶向药物开发。同时,该工作还首次解析了低分辨的GABAB-Gi复合物结构,发现由于潜在的空间位阻,二聚化的GABAB受体仅能偶联一个G蛋白11。然而其非对称激活和偶联G蛋白的信号转导的分子机制还未被揭示。
本研究团队在前期工作的基础上再次进行课题攻关,先后突破复合物组装、均一冷冻样品制备、动态构象数据处理等挑战,最终完成高分辨GABAB受体-Gi蛋白复合物的电镜结构鉴定(图1a)。结构分析发现与单体GPCR不同,GABAB受体偶联G蛋白时,两个亚基跨膜域的TM6均没有发生外移,但是GB2亚基的TM3和TM5却发现较小幅度的外扩,使三个胞内环形成一个较浅的口袋结合G蛋白。与单体GPCR相比,G蛋白α5螺旋插入GABAB受体的深度低了~10?,并且主要与胞内环互作。
这些结果结合以前的其他C型GPCR功能研究,推测C型GPCR二聚体都采用了这种不同于A、B1、B2和F类GPCP的激活的独特的G蛋白偶联模式(图1b-d)。
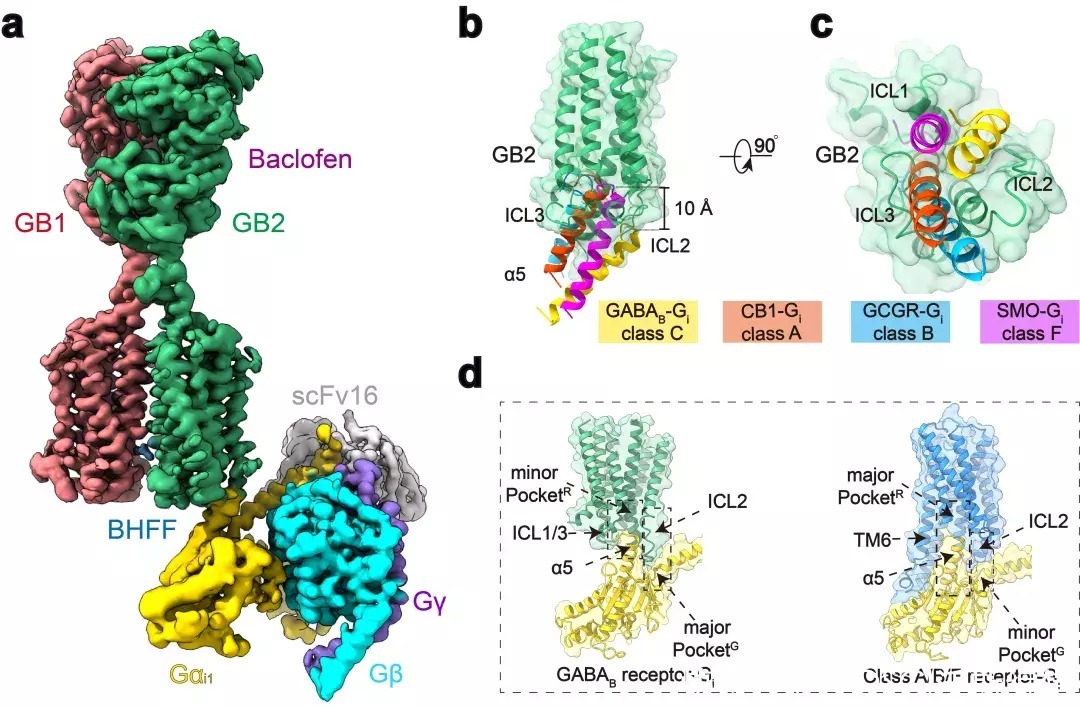
图1:GABAB偶联G蛋白复合物的新颖结构
此外,研究发现了GABAB偶联G蛋白后的精细构象变化,包括GB1和GB2之间的旋转,以及GB2亚基TM的细节变化。通过结构分析,研究人员发现结合激动剂的GABAB受体偶联G蛋白后,其GB2-TM相较于GB1-TM产生进一步的逆时针旋转,使得GB1和GB2的跨膜域界面进一步靠近,稳定激活状态。研究人员专注于GB2-TM的内部精细的构象变化,分析发现GB2 TM3/TM5胞内端的构象变化是起始于TM3上F586侧链苯环的大角度旋转。
信号转导实验分析发现,将F586突变成小侧链丙氨酸后,受体偶联G蛋白的能力显著下降。此外,在GB2-TM的底部,多个带电荷的氨基酸形成的盐桥进一步稳定了受体的激活态,从而揭示了GB2亚基结合G蛋白的结构基础(图2)。GB2亚基这些独特的构象的变化,最终决定了GABAB偶联G蛋白的非对称性激活模式。
文章来源:《生命科学仪器》 网址: http://www.smkxyq.cn/zonghexinwen/2021/0513/550.html
上一篇:汇友生命科学(08088)已向上市复核委员会提供书面
下一篇:汇友生命科学(08088)预期一季度亏损收窄40%至50%